Alcoholes-Fenoles y Éteres
ALCOHOLES
| ||||||
Su estructura es similar a la de los hidrocarburos, en los que se sustituye uno o más átomos de hidrógeno por grupos "hidroxilo", -OH.
| ||||||
¿Cómo se nombran?
| ||||||
Tipos de alcoholes
La palabra alcohol alude a aquellos compuestos químicos que sean el resultado de la sustitución de átomos de hidrógeno por grupos hidroxilos en los hidrocarburos, ya sean saturados o no. Dentro de la química se habla de los siguientes tipos de alcohol:
Metanol: también conocido bajo el nombre de alcohol metílico o de quemar presenta la siguiente fórmula química: CH3OH y se caracteriza por presentar una estructura química próxima a la del agua.
En estado natural, este alcohol es incoloro, líquido y con sabor y olor frutal. Además, es inflamable y sumamente tóxico. Si se lo mezcla con aire, puede originar combustibles con elevado poder calorífico. Es a partir de este compuesto que se obtienen el metano y el formol.
Su obtención proviene de la síntesis de hidrógeno y monóxido de carbono por medio de procesos catalíticos. Para realizar estos procedimientos se utilizan elevadas presiones y temperaturas.
Etanol: también conocido bajo el nombre de alcohol etílico o simplemente alcohol, se caracteriza por ser líquido, incoloro y con gusto a quemado. Su fórmula química es H3C-CH2-OH y es el alcohol utilizado para la producción de bebidas alcohólicas tales como el vino, la sidra y el brandy, entre otras. Para la obtención del etanol, sin presencia de agua, se recurre a procesos de destilación azeotrópicas en ciclohexano o benceno. Además de ser utilizado en la producción de bebidas alcohólicas, el etanol es requerido en el ámbito de la industria química, farmacéutica e industrial. También, es usado para combustibles domésticos e incluso industriales.
Hay que tener en cuenta que su consumo afecta a la coordinación de los miembros del cuerpo, a la visión y también puede ocasionar somnolencia, mareos y euforia.
Butanol: también conocido bajo el nombre de alcohol butílico, este compuesto orgánico se caracteriza por encontrarse en estado líquido, ser incoloro, poseer un aroma particular. Además, es muy inflamable y soluble en agua. Su fórmula química es H3C-(CH2)3-OH y se lo utiliza para síntesis orgánicas de ésteres disolventes, en coloraciones, también es usado como disolvente, como agente deshidratante y para la producción de detergente, entre otras cosas. El butanol es obtenido a partir de trietil aluminio y del óxido de etileno.
En caso de ser inhalado, puede ocasionar anestesia, tos, sueño, dificultades en la respiración y aturdimiento. Si llega a entrar en contacto con la piel o con los ojos ocasiona irritación.
Octanol: éste se encuentra naturalmente en aceites esenciales en forma de ésteres. Se lo usa principalmente para la producción de ésteres que son requeridos para generar sabores y en el área de perfumería, también es utilizado en el ámbito de la medicina para la realización de experimentos. Su fórmula química es CH3(CH2)7OH
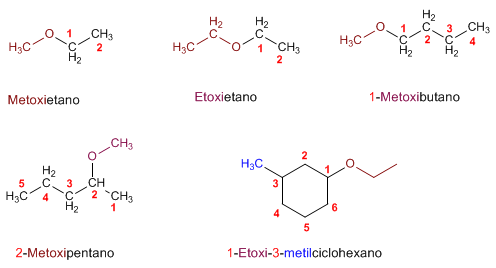
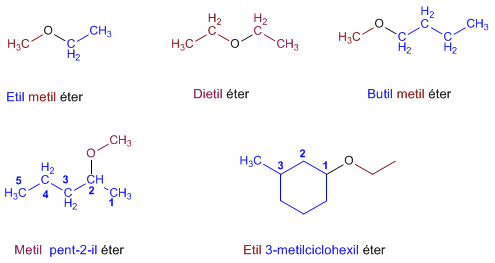
NOMENCLATURA
-ol
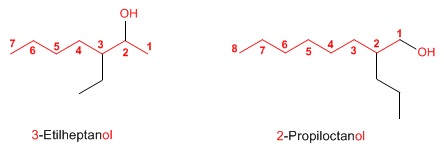 Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH. Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH. Regla 2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.  Regla 3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por Regla 4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas. 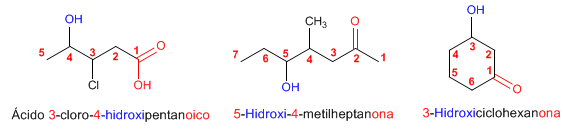 Regla 5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol. 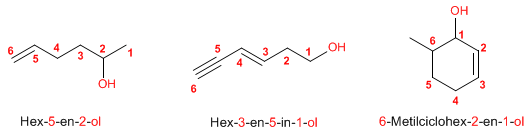 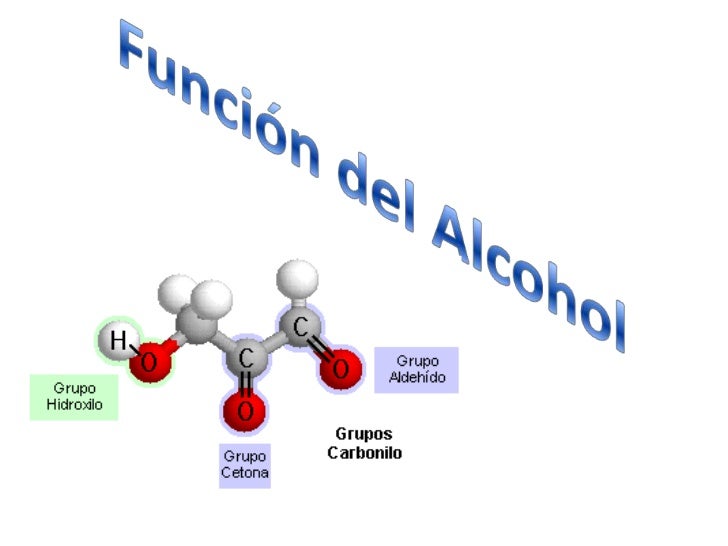  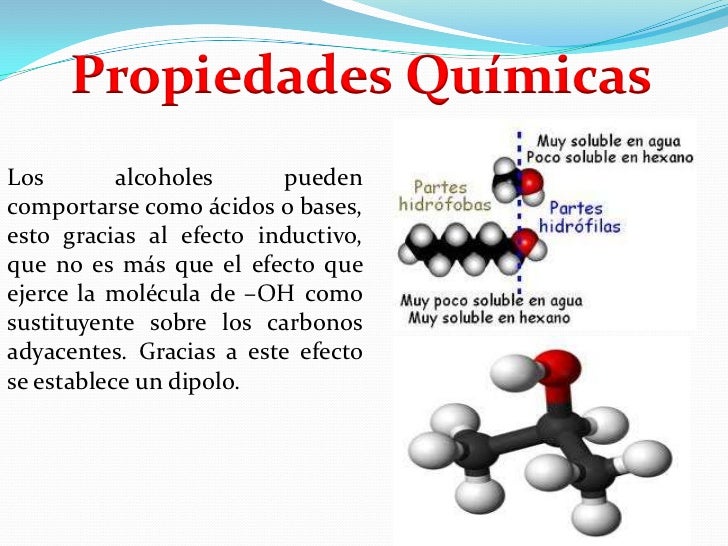
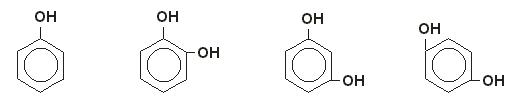
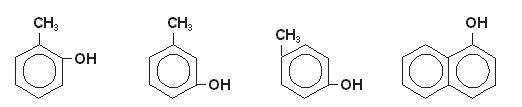
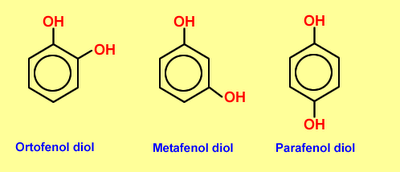
LOS FENOLES:
son compuestos químicos llamados aromáticos. Las sustancias provienen de los alcoholes aromáticos. Existen varios tipos de fenoles: los ácido-fenoles, las flavonas, los taninos y los antocianos. Si una sustancia posee más de un fenolla denominamos polifenol
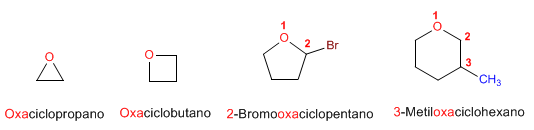
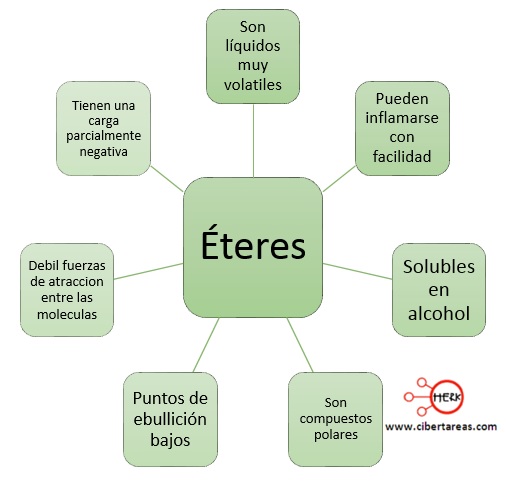
Fenoles – Nomenclatura y ejemplos |

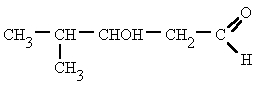



Comentarios
Publicar un comentario